Los científicos del grupo Park, equipo de investigación del Departamento de Bioquímica y Biología Molecular y Genética de la Facultad de Enfermería y Terapia Ocupacional de la Universidad de Extremadura y CIBERNED, han apuntado a la modulación de la actividad deacetilasa de la proteína SIRT1, que contribuye a la regulación y a la longevidad celular, como diana para el diseño de tratamientos que combatan la enfermedad de Parkinson en aquellos pacientes en los que su causa se desconoce. Lo esencial de esas terapias es que ralentizarían o incluso detendrían el avance de la enfermedad.
El tratamiento para estos pacientes cuya enfermedad de Parkinson tiene un origen indeterminado consistiría en alcanzar un nivel basal de mitofagia suficiente mediante la potenciación de la actividad deacetilasa de la proteína SIRT1, explica Sokhna M. S. Yakhine-Diop, doctora en Bioquímica y Biología Molecular y Genética por la Universidad de Extremadura y autora principal del paper de la investigación. La posibilidad de dicha terapia es gracias al estudio del mecanismo molecular de la enfermedad de Parkinson. “Así, podemos hallar vías de señalizaciones que se encuentran modificadas en las células de los pacientes y diseñar fármacos que actúen específicamente sobre esos puntos”, indica Yakhine-Diop.
SIRT1 es una proteína que regula el proceso celular de la mitofagia, una forma de autofagia selectiva. La autofagia consiste en la degradación y reciclaje de aquellas proteínas que no se usan, que están defectuosas y de aquellos orgánulos celulares que están dañados. La mitofagia es la degradación y reciclaje selectivos de las mitocondrias, orgánulos celulares que se encargan de suministrar la mayor parte de la energía necesaria para la actividad celular. Tanto la autofagia como la mitofagia están alteradas en las células de los pacientes de Parkinson.
SIRT1 pertenece al grupo de las proteínas histonas deacetilasas. Estas proteínas se encargan de deacetilar, es decir, de eliminar de las estructuras proteicas una molécula denominada grupo acetilo. Las proteínas histona acetiltransferasas se encargan, por su parte, de acetilar, de añadir esos grupos acetilo. La acetilación y la deacetilación son reacciones químicas que modifican las proteínas e influyen en sus actividades y funciones.
La mayoría de los casos de enfermedad de Parkinson son idiopáticos, que se refiere a que son debidos a causas desconocidas. Aun así, se sospecha que se producen por factores ambientales, como la exposición a determinadas toxinas. Sin embargo, sí que se conocen algunas causas específicas como mutaciones genéticas, que representan el 10% de los casos de Parkinson. Mediante cultivos celulares cedidos por el doctor Adolfo López de Munain, Jefe de Sección del Servicio de Neurología del Hospital Universitario Donostia, los investigadores del grupo Park analizaron el estado de acetilación de las proteínas en fibroblastos (células del tejido conectivo) de individuos sanos que actuaron de control, enfermos de Parkinson debido a la mutación G2019S LRRK2 y pacientes cuya enfermedad de Parkinson es de causa desconocida. Los científicos observaron un estado de hiperacetilación en aquellas células que contenían la mutación G2019S LRRK2 e hipoacetilación en los casos cuyas causas eran desconocidas.
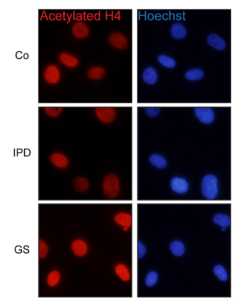
Imagen de inmunofluorescencia, una técnica de detección mediante anticuerpos unidos a una sustancia fluorescente. En rojo se puede apreciar cómo las proteínas de las células de enfermos de Parkinson de causa desconocida (IPD) están menos acetiladas que las de las células control (Co) y las células con la mutación G2019S LRRK2. En azul están marcados los núcleos de dichas células. Yakhine-Diop et al., 2018. Frontiers in celular Neuroscience.
Infogram
Sin embargo, al fijarse en las proteínas que regulan la autofagia, vieron en las células con la mutación G2019S LRRK2 que la proteína histona deacetilasa SIRT1 se encuentra fosforilada, es decir, con un grupo fosfato, lo cual desencadena su activación, y desfosforilada en aquellas cuya enfermedad de Parkinson era de origen desconocido. Todo esto se traduce en que en las células de los pacientes de Parkinson con la mutación genética G2019S LRRK2 se lleva a cabo la mitofagia. Mientras, en las células de los pacientes de Parkinson de causa desconocida la mitofagia está disminuida. Vieron una mayor muerte celular en las muestras de los casos de origen desconocido que en las de la mutación G2019S LRRK2, por lo que llegaron a la conclusión del efecto protector de la mitofagia.
Para las células con la mutación genética G2019S LRRK2 todavía no está claro cuál sería la táctica adecuada para combatir la patología. Esto quiere decir que no hay un tratamiento único para todos los enfermos de Parkinson. “Cada paciente es un mundo y habría que abogar por analizar qué ocurre en sus procesos moleculares para diseñar una terapia personalizada. Aunque puedan tener muchas cosas en común entre ellos, un tratamiento generalizado no tiene por qué funcionar para todos”, concluye Yakhine-Diop.
En el futuro, esperan ampliar la investigación a las alteraciones en el metabolismo para encontrar biomarcadores de la enfermedad de Parkinson. Los biomarcadores son moléculas cuyos niveles o función sirven como indicador del estado biológico del individuo, aportando información sobre si está sano o enfermo. Su identificación es clave para la detección temprana de distintas patologías. En la actualidad, los signos clínicos son la única opción de diagnóstico de Parkinson, cuando ya la mayoría de neuronas se han degenerado y sólo se pueden mitigar los síntomas. “Con los biomarcadores y junto al estudio de los mecanismos moleculares de la enfermedad de Parkinson se podría conseguir un diagnóstico precoz y el diseño de fármacos para tratarla antes de que esté muy avanzada y fuera demasiado tarde. Ese es nuestro objetivo”, señala Yakhine-Diop.
Artículos:
- Yakhine-Diop, S., Niso-Santano, M., Rodríguez-Arribas, M., Gómez-Sánchez, R., Martínez-Chacón, G., & Uribe-Carretero, E. et al. (2018). Impaired Mitophagy and Protein Acetylation Levels in Fibroblasts from Parkinson’s Disease Patients. Molecular Neurobiology, 56(4), 2466-2481. doi: 10.1007/s12035-018-1206-6
- Yakhine-Diop, S., Rodríguez-Arribas, M., Martínez-Chacón, G., Uribe-Carretero, E., Gómez-Sánchez, R., & Aiastui, A. et al. (2018). Acetylome in Human Fibroblasts From Parkinson’s Disease Patients. Frontiers In Cellular Neuroscience, 12. doi: 10.3389/fncel.2018.00097
Si quieres pasar un buen rato y poner a prueba tus conocimientos acerca de la noticia te invitamos a hacer el siguiente test:
